Линко
Новая платформаЛинко
Скрыть менюГлавная
Поиск. Обзор сервисов Назад в раздел
Статьи по данной теме


Рассмотрим требования к лаборатории в области внутренних проверок, корректирующих действий и сосредоточим внимание на формировании документарной основы по данным вопросам. После этого мы составим соответствующие разделы Руководства по качеству.
Что такое несоответствие?
Требования ГОСТ 17025 к корректирующим действиям (КД)
Реализация требований к КД в Руководстве по качеству
Внутренние аудиты (ВА) лаборатории
Требования ГОСТ 17025 к ВА
Реализация требований к ВА в Руководстве по качеству
В этой статье мы рассмотрим требования к лаборатории в области внутренних проверок, корректирующих действий и сосредоточим внимание на формировании документарной основы по данным вопросам. После этого мы составим соответствующие разделы Руководства по качеству.
В первой части статьи мы поговорим о корректирующих действиях, а во второй части – о внутренних аудитах. Для начала дадим определение, что такое несоответствие:
Несоответствие – это невыполнение установленного требования (например: нормативных документов, методик, стандартов, процедур, установленных в лаборатории).
Рассмотрим требования стандарта ГОСТ ISO/IEC 17025–2019.
Данные требования определены в разделе 8.7 «Корректирующие действия (вариант А)».
8.7.1. При выявлении несоответствия лаборатория должна:
a) реагировать на несоответствие и при необходимости:
b) оценить необходимость действия для устранения причин(ы) несоответствия, для того чтобы предупредить его повторное или новое проявление, посредством:
c) предпринять необходимые действия;
d) оценить результативность предпринятых корректирующих действий;
e) повторно оценить риски и возможности, выявленные по итогам планирования, если это необходимо;
f) при необходимости внести изменения в систему менеджмента.
8.7.2. Корректирующие действия должны соответствовать масштабам и последствиям обнаруженного несоответствия.
8.7.3. Лаборатория должна сохранять записи в качестве свидетельств следующего:
а) сущности несоответствий, причин(ы) и любых предпринятых последующих действий;
b) результатов корректирующих действий.
Процедуру «Корректирующие действия» удобно рассмотреть в виде схемы. На схеме мы отразим основные элементы процедуры, что даст более простое понимание об ее устройстве. После этого мы регламентируем разработанный порядок в Руководстве по качеству, сформулировав конкретные его пункты.
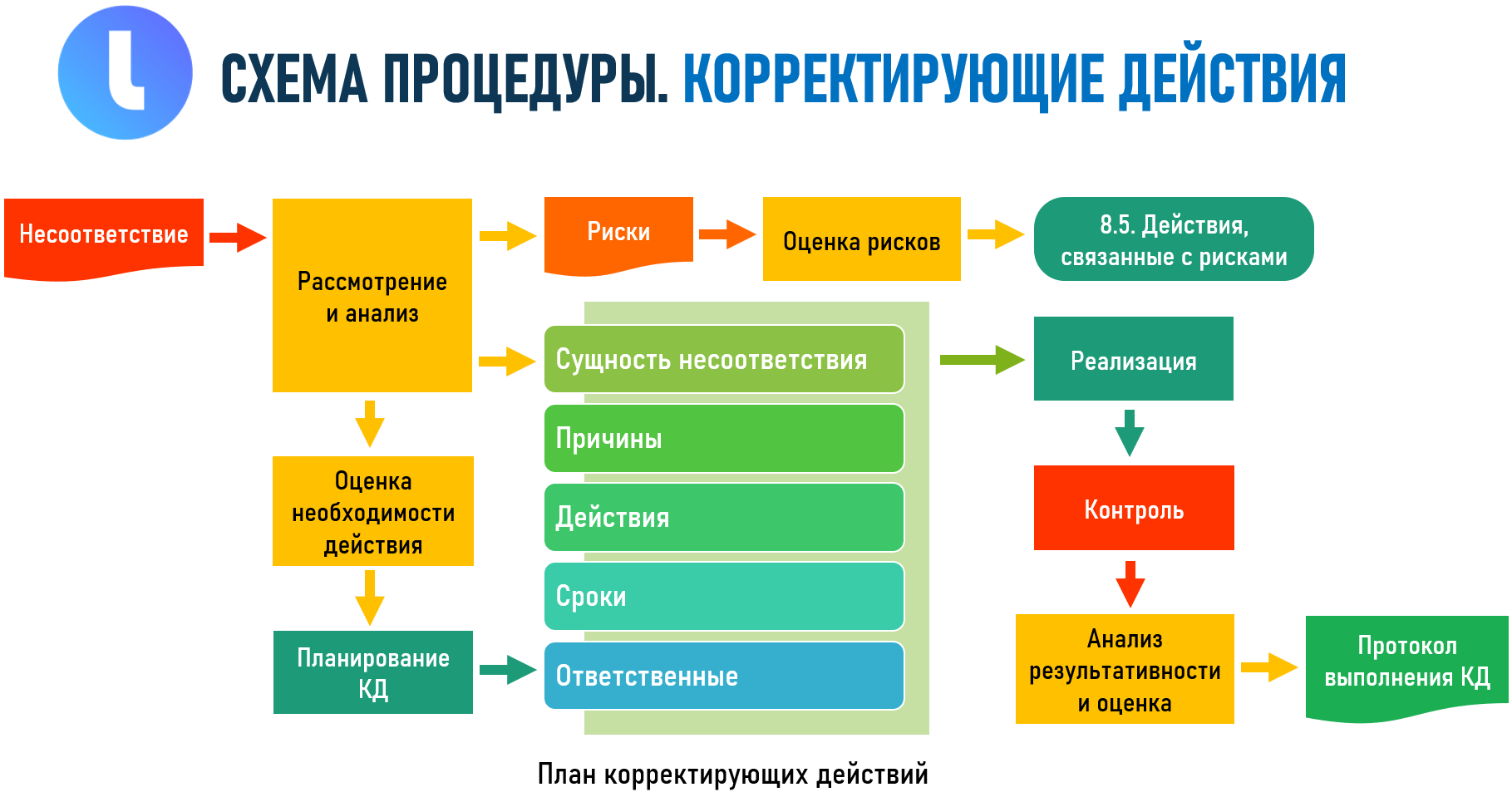
Теперь составим руководство по качеству. Все правила опишем в разделе 8.7, который назовем «Корректирующие действия».
8.7.1. Данная процедура реализована с целью управления несоответствиями, выявленными в ходе осуществления лабораторной деятельности.
8.7.2. В случае выявления несоответствия необходимо рассмотреть и провести его анализ с целью выявления причин возникновения данного несоответствия, а также с целью выявления потенциальной возможности (риска) его повторного возникновения. Оценить необходимость действия для управления, в том числе устранения причин(ы) несоответствия для того, чтобы предупредить его повторное появление.
8.7.3. В случае необходимости следует запланировать выполнение корректирующих действий. Планируемые корректирующие действия должны соответствовать масштабам и последствиям обнаруженных несоответствий. Корректирующие действия должны быть достаточны для устранения несоответствий.
8.7.4. В лаборатории ведутся и сохраняются записи о сущности несоответствий, причин(ы) и любых предпринятых действий. Данные записи документируются в Плане корректирующих действий (П-NN-ГГ см. Альбом форм записей). Ответственность за документирование данных записей несет Менеджер по качеству.
8.7.5. Выявленные риски, связанные с потенциальной возможностью повторного возникновения несоответствия, управляются и документируются в соответствии с процедурой, описанной в разделе 8.5 настоящего Руководства по качеству «Действия, связанные с рисками».
8.7.6. План корректирующих действий, содержащий записи о сущности несоответствий, причин(ы) и любых предпринятых действий также включает в себя сроки и сотрудников, ответственных за их выполнение. Разработанный План корректирующих действий утверждает Руководитель лаборатории. После ознакомления с Планом ответственные сотрудники реализуют запланированные мероприятия.
8.7.7. Контроль выполнения мероприятий и анализ их результативности осуществляет Менеджер по качеству. Результаты выполнения корректирующих действий и оценка результативности документируются в Протоколе выполнения корректирующих действий (Пр-NN-ГГ см. Альбом форм записей).
8.7.8. В случае, если результативность выполненных корректирующих действий указывает на неустранение или частичное устранение несоответствия, то принимается решение о повторном проведении корректирующих действий и (или) их дополнении. При необходимости принимается решение о пересмотре причин несоответствия, об их анализе, анализе рисков, связанных с потенциальной возможностью повторного возникновения несоответствия. Данные решения оформляются в Плане корректирующих действий.
8.7.9. В случае невозможности проведения корректирующих действий, которые могли бы привести к устранению несоответствия, следует принять дополнительные меры по исключению влияния несоответствия на результаты испытаний. К таким мерам можно отнести, например: передачу работ по исследованиям в другую лабораторию, аренду оборудования, приобретение необходимых товаров или услуг и другие меры.
Таким образом, мы охватили все требования ГОСТ ISO/IEC 17025–2019.
Теперь рассмотрим процедуру «Внутренний аудит». Дадим определение термину:
Внутренний аудит лаборатории – независимая форма контроля и оценки лабораторной деятельности, осуществляемая лабораторией в своих интересах.
Стандарт ГОСТ ISO/IEC 17025–2019 содержит всего два пункта требований, а вот руководящие указания для проведения внутренних аудитов, на которые ссылается данный стандарт, можно изучить в ГОСТ Р ИСО 19011–2021 «Руководящие указания по проведению аудита систем менеджмента». Этот стандарт объемен и несомненно важен для изучения и применения. Он позволяет снять множество возникающих вопросов в процессе организации деятельности, связанных с внутренними аудитами, таких как состав аудиторской группы и компетентность аудиторов. В этой статье мы ограничимся требованиями ГОСТ ISO/IEC 17025–2019, а далее, по мере развития темы в следующих статьях, мы полностью погрузимся в этот материал.
Рассмотрим требования ГОСТ ISO/IEC 17025–2019.
Данные требования определены в разделе 8.8 «Внутренние аудиты (вариант А)».
8.8.1. Лаборатория должна проводить внутренние аудиты через запланированные интервалы для получения информации о том, является ли система менеджмента:
а) соответствующей:
b) результативно внедренной и реализуемой.
8.8.2. Лаборатория должна:
a) планировать, разрабатывать, внедрять и реализовывать программу аудита, в том числе в отношении периодичности, методов, сферы ответственности, планируемых требований и отчетности, которая должна учитывать важность соответствующей лабораторной деятельности, изменения, влияющие на лабораторию, а также результаты предыдущих аудитов;
b) определять критерии аудита и область проведения каждого аудита;
c) обеспечивать, что результаты аудита доведены до соответствующего руководства;
d) выполнять соответствующие коррекции и корректирующие действия без необоснованных задержек;
e) сохранять записи в качестве подтверждения реализации программы аудита и результатов аудитов.
Организация данной процедуры в деталях будет рассмотрена на схеме в следующих статьях, при разработке отдельных процессов и создании соответствующих документов системы менеджмента.
Теперь составим основные положения Руководства по качеству и определим их в раздел 8.8 «Внутренние аудиты».
Сформулируем цель процедуры, которая будет охватывать требования первого пункта. От данной цели мы будем отталкиваться в процессе построения процедуры в дальнейшем, и это позволит понять, выполняется ли цель процедуры в процессе ее реализации.
8.8.1. Данная процедура реализована с целью контроля и получения информации о том, является ли система менеджмента соответствующей установленным лабораторией для нее требованиям, в том числе требований к лабораторной деятельности, требованиям применяемых стандартов, стандарта ГОСТ ISO/IEC 17025–2019 и критериев аккредитации, является ли система менеджмента результативно внедренной и реализуемой.
Теперь в общем опишем, что необходимо сделать для выполнения данной цели.
8.8.2. Для этих целей в лаборатории проводятся внутренние аудиты через запланированные интервалы времени.
Так как процедуру мы выносим в отдельный документ, то нам необходимо указать на него соответствующую ссылку и ёмко указать, какие именно требования мы определяем в ней, чтобы из Руководства по качеству было понятно, что требования ГОСТ ISO/IEC 17025–2019 не упущены и прослеживаются.
8.8.3. Порядок организации и проведения внутренних аудитов, включая разработку планов аудитов, назначение ответственных лиц за их проведение, порядок регистрации информации по результатам аудитов, их рассмотрения и оценки, определен в документированной процедуре «Внутренние аудиты» (ДП-N-ГГ).
Центром реализации выполнения второго пункта требований станет Программа аудита.
8.8.4. В лаборатории разработана, внедрена и реализуется Программа аудита (П-N-ГГ), в том числе в отношении периодичности, методов, сферы ответственности, планируемых требований и отчетности, которая учитывает важность лабораторной деятельности, изменения, влияющие на лабораторию, а также результаты предыдущих аудитов.
Программа аудита является основой всей процедуры и от нее возьмет начало следующий процесс – Планирование аудита. Детально все процессы мы определим в документированной процедуре. При этом в Руководстве по качеству ёмко обозначим, что установленные вторым пунктом требования выполняются, а правила определены в отдельной процедуре.
8.8.5. Лаборатория проводит планирование аудитов, определение критериев и области проведения каждого аудита, порядок обеспечения доведения результатов аудита до руководства лаборатории; осуществляет выполнение соответствующих коррекций и корректирующих действий без необоснованных задержек; cохраняет записи в качестве подтверждения реализации программы аудита и результатов аудита. Это обеспечивается выполнением документированной процедуры «Внутренние аудиты» (ДП-N-ГГ).
Мы получили пример того, как корректно сделать ссылки на документированную процедуру из Руководства по качеству. При этом важно подчеркнуть, что ни одна деталь из требований стандарта не упущена и прослеживается. Нарушение прослеживаемости от стандарта к конкретным определениям реализации процессов не является однозначно чем-либо некорректным. При этом соблюдение принципа прослеживаемости отражает грамотный подход к построению внутренней документации лаборатории.
5 мая 2022 г. 9:38
 Записаться
Записаться
 Записаться
Записаться
 Записаться
Записаться
.jpg) Записаться
Записаться