Линко
Новая платформаЛинко
Скрыть менюГлавная
Поиск. Обзор сервисов Открытая разработка
Большая коллекция готовых процедур и инструкций ОРД - 2025
Новая разработка документов Руководство по качеству
Разработано сообществом
1. Определение политики в области качества
2. Беспристрастность
3. Помещения и условия окружающей среды
4. Управление рисками
5. Взаимодействие с надзорными и контролирующими органами
6. Управление оборудованием, включая программное обеспечение
7. Карта оценки рисков
Реестр рисков испытательной лаборатории
Что такое реестр рисков?
Реестр рисков — это документ, в котором систематизированы и описаны все потенциальные риски, которые могут возникнуть в процессе работы испытательной лаборатории. Он позволяет руководству лаборатории оценить вероятность возникновения рисков и их возможные последствия, разработать меры по предотвращению или снижению рисков, а также контролировать эффективность принятых мер.
Требования ГОСТ 17025 к управлению рисками
В соответствии с ГОСТ 17025, испытательные лаборатории должны разрабатывать, внедрять и поддерживать в рабочем состоянии процедуру управления рисками. Эта процедура должна включать в себя:
Идентификацию рисков: определение всех потенциальных рисков, которые могут повлиять на качество и достоверность результатов испытаний. Анализ рисков: оценка вероятности возникновения рисков и их возможных последствий.
Меры по предотвращению или снижению рисков: разработка и внедрение мер, направленных на предотвращение или снижение вероятности возникновения рисков или их возможных последствий. Мониторинг и анализ эффективности принятых мер: регулярный пересмотр и обновление реестра рисков, оценка эффективности принятых мер и внесение необходимых изменений.
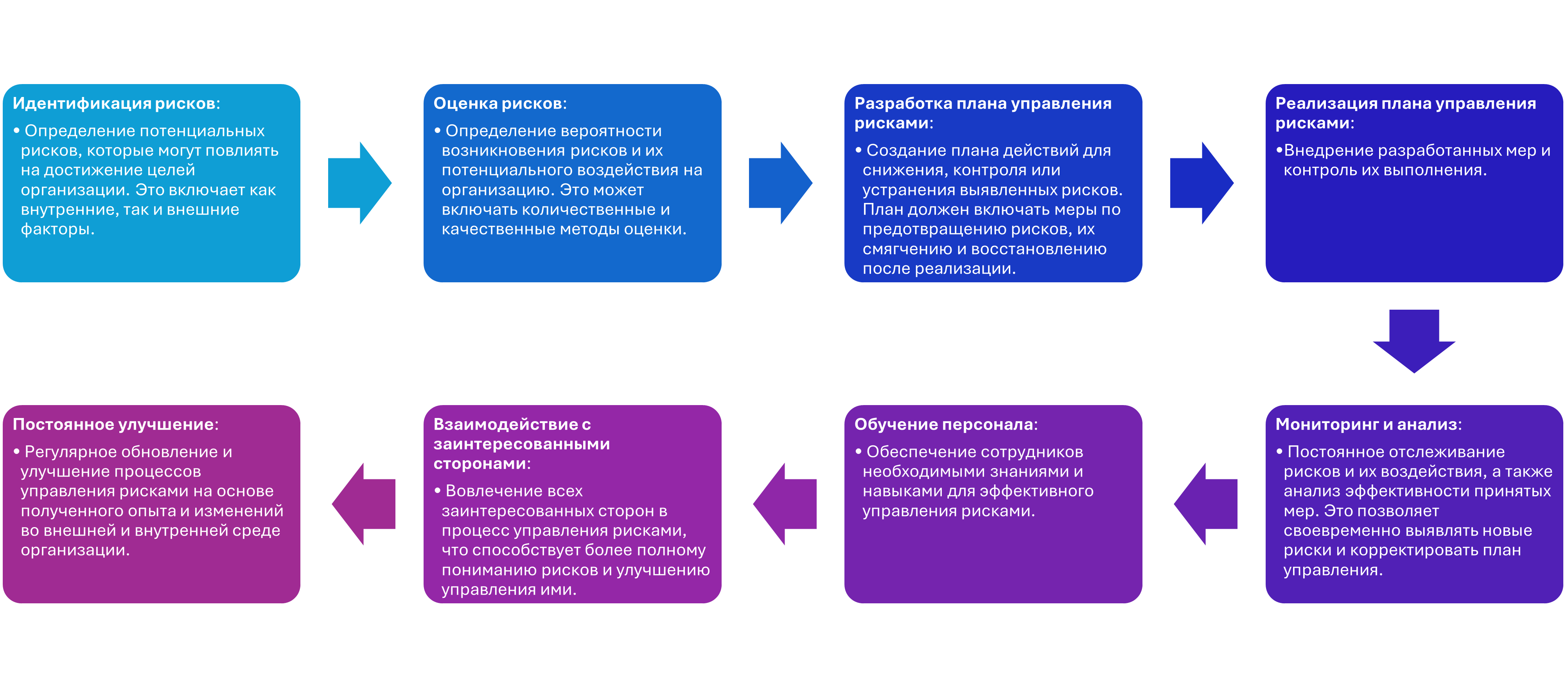
Как составить реестр рисков?
Составление реестра рисков — это итеративный процесс, который должен проводиться регулярно. Вот основные шаги, которые помогут вам составить эффективный реестр рисков:
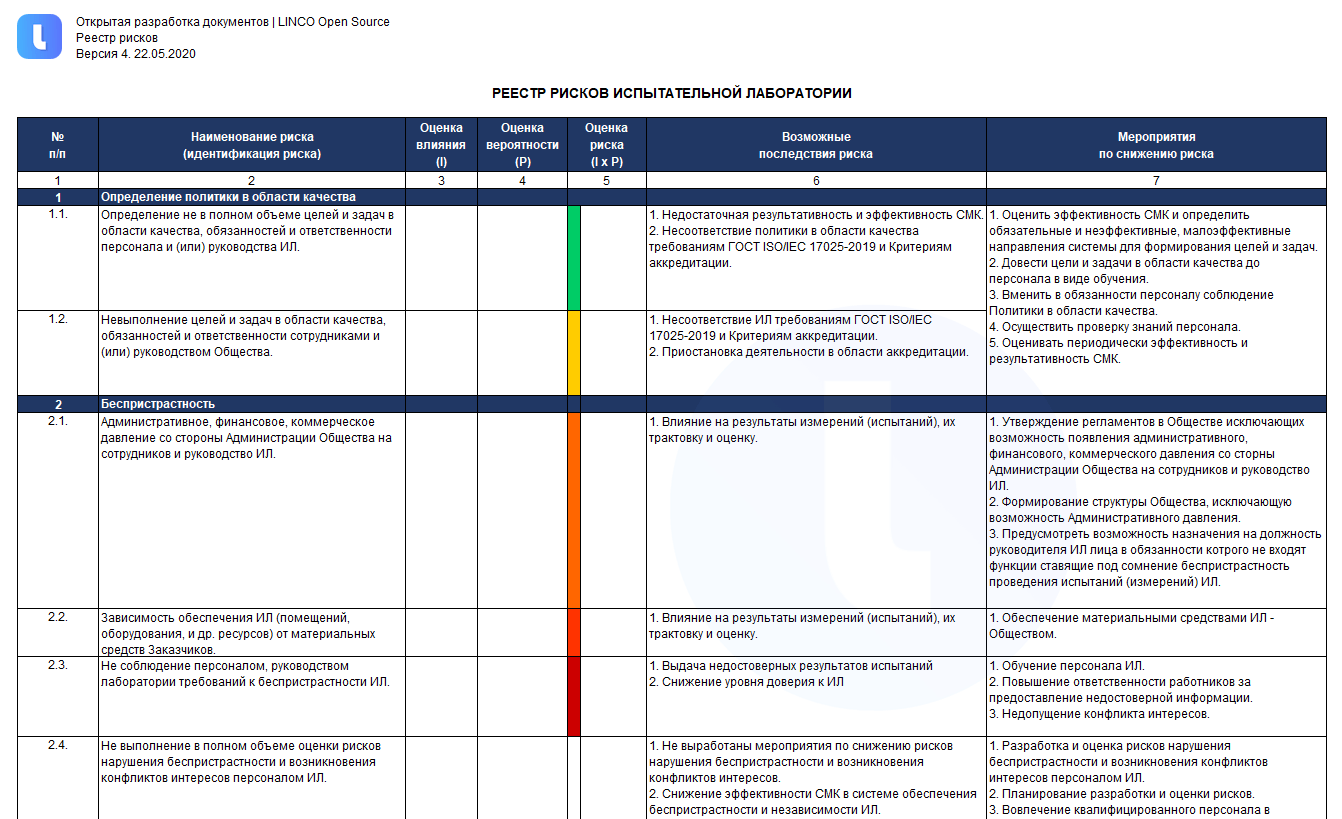
Пример реестра рисков
Вот пример реестра рисков, который может быть использован в испытательной лаборатории: это лишь пример реестра рисков. В зависимости от специфики вашей лаборатории вы можете добавить или удалить риски, а также изменить их описание.
| № | Риск | Вероятность | Последствия | Меры по предотвращению или снижению рисков |
|---|---|---|---|---|
| 1 | Отказ оборудования | Средняя | Потеря результатов испытаний | Регулярное техническое обслуживание оборудования |
| 2 | Некомпетентность персонала | Низкая | Снижение качества результатов испытаний | Обучение персонала |
| 3 | Несоответствие требованиям стандартов | Средняя | Потеря доверия к лаборатории | Внедрение систем управления качеством |
| 4 | Несвоевременное получение образцов | Средняя | Задержка в проведении испытаний | Улучшение взаимодействия с заказчиками |
| 5 | Изменение законодательства | Низкая | Дополнительные затраты на приведение лаборатории в соответствие с новыми требованиями | Мониторинг изменений в законодательстве |
Заключение
Реестр рисков — это важный инструмент, который позволяет испытательным лабораториям управлять рисками и обеспечивать высокое качество и достоверность результатов испытаний. Составление реестра рисков — это итеративный процесс, который требует регулярного пересмотра и обновления.
Открыть Скачать
Популярный сервис, который помогает тысячам лабораторий. Рассказываем о преимуществах проекта, создаваемого трудом лабораторного сообщества.
 Записаться
Записаться
 Записаться
Записаться
 Записаться
Записаться
.jpg) Записаться
Записаться
.png) Записаться
Записаться