Линко
Новая платформаЛинко
Скрыть менюГлавная
Поиск. Обзор сервисов Назад в раздел
Статьи по данной теме


Работа в лаборатории неразрывно связана с применением различных реактивов, поэтому каждая лаборатория обязательно имеет определенный запас их. К каждому реактиву может быть применено понятие жизненного цикла, включающее приобретение, входной контроль, учет, использование и утилизацию с возможными дополнениями. В данной статье мы опишем каждый этап и сосредоточим внимание на учете реактивов и прекурсоров, в том числе с помощью электронных журналов.
Требования к обеспечению реактивами
Жизненный цикл реактива в лаборатории
Заказ и приобретение
Входной контроль
Учет и этикетирование
Учет прекурсоров
Хранение
Продление срока годности реактива
Требования к обеспечению реактивами |
Работа в лаборатории неразрывно связана с применением различных реактивов, поэтому каждая лаборатория обязательно имеет определенный запас их. Наличие реактивов и документированных процедур приема, хранения, исследования приемлемости и учета, необходимых для выполнения работ, может быть закреплено законодательно. Так испытательные, калибровочные и медицинские лаборатории, аккредитованные в национальной системе аккредитации, должны соответствовать требованиям ГОСТ ISO/IEC 17025-2019 и ГОСТ Р ИСО 15189-2015 соответственно, а также Критериям аккредитации, утвержденным Приказом Минэкономразвития России от 26 октября 2020 года № 707. Эти основополагающие документы помимо прочего содержат требования к организации процедуры управления реактивами и расходными материалами, позволяющей продемонстрировать прослеживаемость результатов измерений, способность получать технически надежные результаты и компетентность лаборатории в целом.
ГОСТ ISO/IEC 17025-2019 пунктом 6.4.1 сообщает:
Лаборатория должна иметь доступ к оборудованию (включая, но не ограничиваясь, средства измерения, программное обеспечение, эталоны, стандартные образцы, справочные данные, реактивы, расходные материалы или вспомогательные устройства), которое необходимо для надлежащего осуществления лабораторной деятельности и которое может повлиять на ее результаты.
ГОСТ Р ИСО 15189-2015, п. 5.3.2 указывает:
Лаборатория должна иметь документированную процедуру приема, хранения, исследования приемлемости и менеджмента инвентаризации реагентов и расходных материалов … Лаборатория должна ввести систему контроля инвентаризации реагентов и расходных материалов. Система инвентарного контроля должна отделить непроверенные и неприемлемые реагенты и расходные материалы от тех, которые пригодны для использования.
Пункт 24.4 Критериев аккредитации устанавливает требование к лабораториям, выполняющим работы по исследованиям и измерениям в целях обязательного подтверждения соответствия, а также к лабораториям, выполняющим работы по исследованиям (испытаниям) и измерениям:
Наличие по месту (местам) осуществления деятельности в области аккредитации … помещений, испытательного и вспомогательного оборудования, средств измерений и стандартных образцов, соответствующих требованиям законодательства РФ об обеспечении единства измерений, а также иных технических средств и материальных ресурсов, необходимых для выполнения работ по исследованиям (испытаниям) и измерениям ...
Жизненный цикл реактива в лаборатории |
Общий жизненный цикл реактива в лаборатории выглядит следующим образом:
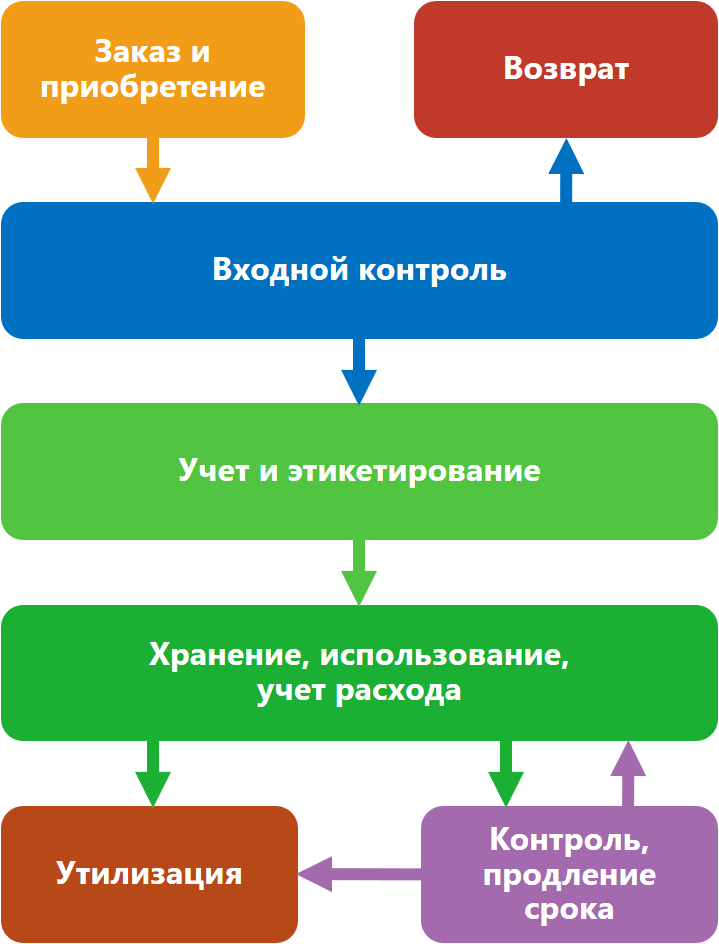
Заказ и приобретение |
Сотрудники лаборатории, исходя из планируемой деятельности, формируют потребность в реактиве на определенный период времени, в течение которого этот реактив будет израсходован. Опираясь на расход реактива согласно методике и ожидаемое количество операций с ним (для новых лабораторий), учитывая практический опыт расхода и цели организации (для уже функционирующих лабораторий), срок хранения определяют количество закупаемого реактива.
Как правило, для всех отделов лаборатории формируется единая Годовая потребность в запасах, согласно которой реактивы приобретаются Отделом закупок в плановом порядке.
Внеплановая потребность в реактиве возникает чаще всего в случае повышенного расхода реактива, его порчи, что указывает на наступление дефицита до совершения следующей закупки, в случае, если срок годности приобретенного ресурса оказывается меньше планируемого.
Входной контроль |
В момент получения реактива сотрудникам лаборатории целесообразно удостовериться в том, что условия хранения и транспортировки реактива исключали его порчу или разрушение. Получение прекурсоров наркотических средств и психотропных веществ, а также эталонных штаммов микроорганизмов, относящихся к ПБА III-IV группы, осуществляют сотрудники, назначенные ответственными руководителем Организации.
Входной контроль призван гарантировать однозначную идентификацию реактива и соответствие предъявляемым к нему требованиям. В рамках входного контроля ответственные сотрудники проверяют целостность упаковок, емкостей для хранения, наличие идентификационных этикеток, срок годности, технические характеристики и сопроводительные документы. Проверка сопроводительной документации обязательно должна включать проверку:
Результаты контроля должны совпадать с данными спецификаций.
Для отдельных отраслей и видов контролируемой деятельности лабораториям может быть предписано проводить с каждой новой партией реактива, когда это возможно, испытание пригодности, заключающееся в верификации функциональных характеристик (например, ГОСТ Р ИСО 15189-2015, п. 5.3.2.3 для медицинских лабораторий). Ранее такое требование было обязательным для всех лабораторий, соответствующих требованиям ГОСТ ИСО /МЭК 17025-2009:
4.6.2. Лаборатория должна обеспечивать сохранность полученных запасов, реактивов и расходных материалов, влияющих на качество испытаний и/или калибровки, до тех пор, пока они не будут проконтролированы или другим образом оценены…
Но новая версия (ГОСТ ISO/IEC 17025-2019) благодаря внедрению риск-ориентированного подхода позволила исключить обязательный входной контроль реактивов, как элемент обеспечения требуемой достоверность результатов анализа, и отнести несоответствие качества реактивов к низким рискам.
Если после визуального входного контроля у лаборатории появляются сомнения в качестве реактива, он может быть подвержен проверке качества по ПНД Ф 12.10.1-2000 «Методические рекомендации по проверке качества химических реактивов, используемых при выполнении количественного химического анализа».
Если по результатам входного контроля выявлены дефекты, не позволяющие использовать реактив, целесообразно составить Акт рекламации и направить претензию поставщику. Несоответствующий реактив следует маркировать этикеткой «несоответствующая продукция» и изолировать для исключения непреднамеренного использования.
Учет и этикетирование |
В основе учета реактивов лежит химическая номенклатура. В России употребляются разные номенклатуры: Роспатент рекомендует использовать идентификацию согласно реестру Химической реферативной службы (CAS − англ. Chemical Abstracts Service), в ГОСТах используются правила ИЮПАК (Международный союз теоретической и прикладной химии). При этом считается разумным для давно известных веществ использовать устоявшиеся тривиальные названия: сода, вода, лимонная кислота, а вот для новых веществ, особенно органических, сложного состава, лучше использовать систематические названия, в которых отражено строение соединения. В медицинской и фармацевтической сфере для идентификации реактивов может использоваться система Международного непатентованного наименования (МНН).
Номер CAS − уникальный числовой идентификатор химических соединений, который позволяет однозначно указать на некое вещество, которое может иметь множество названий и состав которого может быть отображен несколькими способами.
Реактивы, поступившие в лабораторию, прошедшие визуальный контроль и проверку сопроводительных документов, подлежат учету. Наиболее распространенной формой записи для учета реактивов является журнал и его современная форма – журнал электронный. Учет стандартных образцов, эталонных штаммов микроорганизмов, прекурсоров наркотических средств и психотропных веществ, иных расходных материалов целесообразно вести в отдельных журналах. Помимо регистрационных данных фиксируются сведения о проведенном входном контроле. Регистрацию и учет осуществляет ответственный за управление запасами.
Для записи расхода реактивов при бумажном документообороте можно организовать картотеку из листов (карточек), в которые количество израсходованного реактива с датой и подписью исполнителя последовательно вносится до полного его исчерпания. Для этой же цели сегодня можно использовать современные автоматизированные решения, объединяющие в себе журналы учета реактивов, стандартных образцов и прекурсоров.
Для упрощения управления реактивами, включая идентификацию и поиск, целесообразно присваивать учтенным реактивам внутренний идентификационный номер. Такой номер может содержать закодированную информацию об отделе лаборатории, природе реактива, назначении и т. д. Далее персонал лаборатории наносит на емкость с реактивом информационную этикетку с идентификационным номером и определяет место хранения в лаборатории.
В ряде случаев к лабораториям могут применяться дополнительные требования по учету реактивов, включая форму журнала (например, 2674-83 «Методические рекомендации по организации хранения, учета и применения химических реактивов в лабораториях санэпидстанций» и Постановление Правительства РФ № 1846 от 28.10.2021 о представлении сведений о деятельности, связанной с оборотом прекурсоров наркотических средств и психотропных веществ, и регистрации операций, связанных с их оборотом).
Учет прекурсоров |
Согласно требованиям Постановления Правительства Российской Федерации № 681 от 30.06.1998 «Об утверждении перечня средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации» контроль распространяется на все средства и вещества, указанные в настоящем перечне, какими бы фирменными названиями они не обозначались, вне зависимости от их количества и наличия нейтральных компонентов. В указанный перечень входят такие прекурсоры, как: серная кислота, соляная кислота, уксусная кислота, перманганат калия, ацетон, толуол.
Согласно требованиям ч.4 ст.30 Федерального закона «О наркотических средствах и психотропных веществах» любые операции, при которых изменяется количество прекурсоров, подлежат регистрации в специальных журналах лицами, на которых эта обязанность возложена приказом руководителя юридического лица.
Форма журнала регистрации операций, при которых изменяется количество прекурсоров наркотических средств и психотропных веществ, регламентирована постановлением Правительства РФ № 1846 от 28.10.2021 «О представлении сведений о деятельности, связанной с оборотом прекурсоров наркотических средств и психотропных веществ, и регистрации операций, связанных с их оборотом, и признании утратившими силу некоторых решений Правительства Российской Федерации». Для удобства расход прекурсора в течение дня может фиксироваться на Листах ежедневного учета прекурсоров с последующим переносом данных в журнал. Следует отметить, что многие цифровые решения защищены от несанкционированного внесения изменений и могут быть использованы для учета прекурсоров наравне с традиционными листами учета и прошитыми бумажными журналами, хранящимися в металлическом шкафу под ключом.
Подробнее об обращении и учете прекурсоров вы можете прочитать в статье «Организация деятельности по обращению с прекурсорами».
Хранение |
Реактивы хранятся на складе лаборатории и на рабочих местах в специально отведенных для этого шкафах в условиях, обеспечивающих их сохранность и целостность, в соответствии со спецификациями изготовителя. На рабочих местах едкие вещества хранятся в шкафах с вытяжкой на специальных поддонах, легковоспламеняющиеся жидкости (этанол, гексан, эфир и др.) – в количестве, не превышающем суточной потребности.
При необходимости стандартные образцы и ПБА III-IV группы размещаются на хранение в холодильнике, закрывающемся на ключ. Места хранения идентифицируются с указанием температурных режимов, где это необходимо.
Прекурсоры наркотических средств и психотропных веществ хранятся в металлическом сейфе с ограниченным доступом, ключ от которого находится у ответственного за учет и выдачу прекурсоров наркотических средств и психотропных веществ.
Продление срока годности реактива |
По истечению гарантийного срока хранения может быть применена проверка пригодности реактива в соответствии с ПНД Ф 12.10.1-2000 «Методические рекомендации по проверке качества химических реактивов, используемых при выполнении количественного химического анализа» и РМГ 59-2019 «Государственная система обеспечения единства измерений (ГСИ). Проверка пригодности к применению в лаборатории реактивов с истекшим сроком хранения способом внутрилабораторного контроля точности измерений».
Результат контроля должен быть задокументирован, например путем заполнения Листа контроля качества.
При положительных результатах контроля срок хранения в соответствии с п. 8.5.3 ПНД Ф 12.10.1-2000 может быть продлен на одну треть срока хранения, устанавливаемого нормативным документом на его показатели качества. При этом на ёмкости для хранения реактива наносится отметка о проведенном контроле и установленном сроке хранения.
1. ГОСТ ISO/IEC 17025-2019 «Общие требования к компетентности испытательных и калибровочных лабораторий»;
2. ГОСТ Р ИСО 15189-2015 «Лаборатории медицинские. Частные требования к качеству и компетентности»;
3. Приказ Минэкономразвития России от 26 октября 2020 года № 707 «Об утверждении критериев аккредитации и перечня документов, подтверждающих соответствие заявителя, аккредитованного лица критериям аккредитации»;
4. 2674-83 «Методические рекомендации по организации хранения, учета и применения химических реактивов в лабораториях санэпидстанций»;
5. ПНД Ф 12.10.1-2000 «Методические рекомендации по проверке качества химических реактивов, используемых при выполнении количественного химического анализа»;
6. РМГ 59-2019 «Государственная система обеспечения единства измерений (ГСИ). Проверка пригодности к применению в лаборатории реактивов с истекшим сроком хранения способом внутрилабораторного контроля точности измерений» (скачать);
7. «Техника лабораторных работ» (Воскресенский П.И., 9-е издание) (скачать);
8. Статья «Как образуются названия химических реактивов (химическая номенклатура)» (август 2016);
9. Статья «Организация деятельности по обращению с прекурсорами» (июль 2021).
25 марта 2024 г. 18:05
 Записаться
Записаться
 Записаться
Записаться
 Записаться
Записаться
.jpg) Записаться
Записаться